Roma – Prendendo ispirazione dalla fotosintesi, un team di ricerca ha utilizzato l’energia solare per produrre ammoniaca a basso impatto ambientale. E’ quanto emerge da uno studio guidato dall’Università di Tokyo e pubblicato su Nature Communications. Ogni anno vengono prodotte poco meno di 200 milioni di tonnellate di ammoniaca, e l’80 per cento di queste viene utilizzato per i fertilizzanti. Inoltre, la sua produzione rappresenta circa il 2 per cento dell’intero consumo energetico mondiale e, di conseguenza, circa il 2 per cento delle emissioni globali di anidride carbonica. Gli autori del nuovo studio, il Professor Yoshiaki Nishibayashi del Dipartimento di Chimica Applicata dell’Università di Tokyo e il suo team, sono riusciti a sviluppare un nuovo sistema catalitico per la produzione di ammoniaca a partire da molecole abbondanti presenti sulla Terra, tra cui azoto atmosferico e acqua.
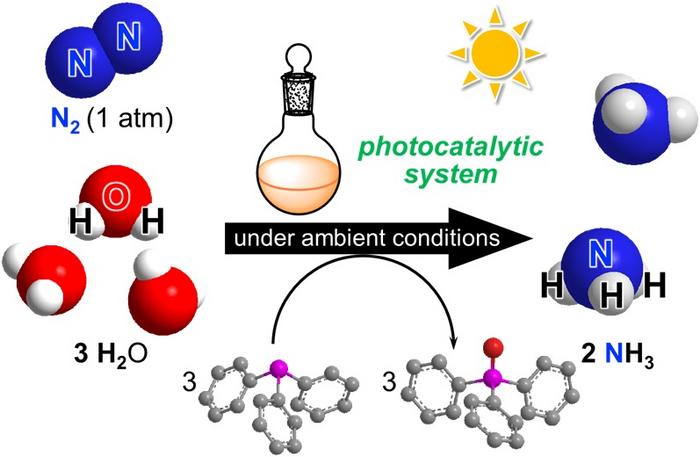
Quando la reazione avviene in condizioni ottimali, due atomi di azoto e tre molecole d’acqua formano due molecole di ammoniaca, lasciando solo ossigeno. ©2025 Nishibayashi et al. CC-BY-ND
Credito
©2025 Nishibayashi et al. CC-BY-ND
La chiave sta nella combinazione di due tipi di catalizzatori, composti intermedi che consentono o accelerano le reazioni senza contribuire alla miscela finale, realizzati appositamente per la produzione di ammoniaca e alimentati dalla luce solare. “Questo è il primo esempio riuscito di produzione fotocatalitica di ammoniaca utilizzando diazoto atmosferico come fonte di azoto e acqua come fonte di protoni, che sfrutta anche l’energia della luce visibile e due tipi di catalizzatori molecolari”, ha affermato Nishibayashi. “Abbiamo utilizzato un fotocatalizzatore all’iridio e un’altra sostanza chimica, la fosfina terziaria, che ha permesso l’attivazione fotochimica delle molecole d’acqua. L’efficienza di reazione è stata superiore alle aspettative, rispetto a precedenti studi sulla formazione di ammoniaca fotocatalitica indotta dalla luce visibile.” Il problema delle reazioni chimiche è che non sempre avvengono alla velocità desiderata o nel modo desiderato. E per controllare il risultato, l’efficienza, i tempi e così via di un processo, è necessario coinvolgere componenti aggiuntivi oltre alle materie prime. È qui che entrano in gioco i catalizzatori. Nishibayashi e il suo team hanno utilizzato due catalizzatori per questi esperimenti, uno basato sul metallo di transizione molibdeno per l’attivazione del diazoto e l’altro basato sul metallo di transizione iridio per la fotoattivazione sia delle fosfine terziarie che dell’acqua. Un terzo componente, chiamato fosfine terziarie, è anch’esso fondamentale per aiutare a estrarre i protoni dalle molecole d’acqua. “Quando il fotocatalizzatore all’iridio assorbe la luce solare, il suo stato eccitato può ossidare le fosfine terziarie. Le fosfine terziarie ossidate attivano quindi le molecole d’acqua attraverso la formazione di un legame chimico tra l’atomo di fosforo della fosfina e l’acqua, producendo protoni”, ha affermato Nishibayashi. “Il catalizzatore al molibdeno consente quindi all’azoto di legarsi a questi protoni per trasformarsi in ammoniaca. L’uso dell’acqua per produrre atomi di diidrogeno o idrogeno è uno dei processi più importanti per ottenere una produzione di ammoniaca ecologica”. Il team è riuscito a produrre questa reazione su una scala 10 volte superiore a quella degli esperimenti precedenti, suggerendo che è pronta per sperimentazioni su scale più ampie, sebbene vi siano ancora alcuni problemi che ove risolti potrebbero migliorarne ulteriormente la sicurezza e l’efficacia. Alcuni componenti, come le fosfine terziarie, potrebbero essere prodotti utilizzando l’energia solare o riciclati dagli ossidi di fosfina. E sebbene siano di per sé stabili, potrebbero essere tossici se ingeriti, quindi sarebbe ideale trovare un modo responsabile per smaltirli o riciclarli. “Nelle piante, l’ammoniaca si forma per fissazione biologica dell’azoto tramite cianobatteri ed è legata alla fotosintesi”, ha affermato Nishibayashi. “Qui, gli elettroni per la reazione sono forniti dalla fotosintesi e i protoni derivano dall’acqua. Pertanto, i risultati del nostro recente studio possono essere considerati un esempio riuscito di fotosintesi artificiale dell’ammoniaca”.(30Science.com)