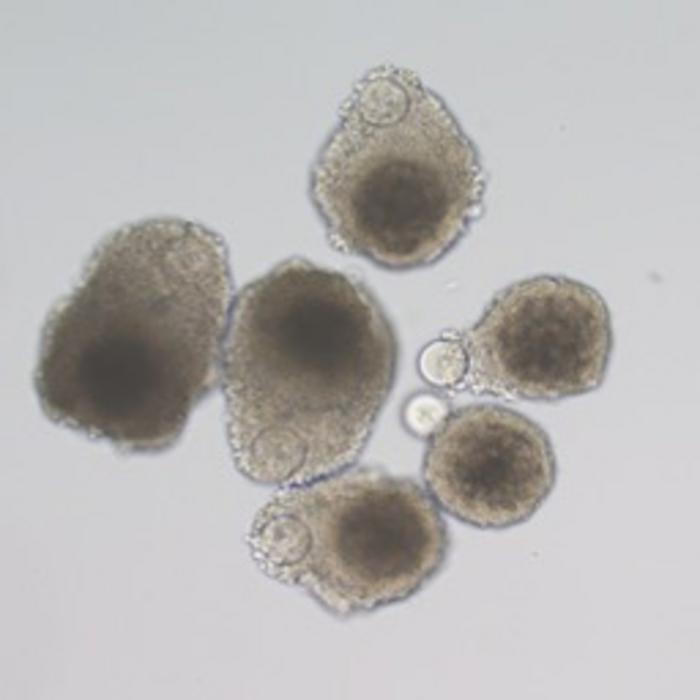
Roma – Sviluppato un metodo per coltivare ovociti da ovociti non maturi in laboratorio, con implicazioni per superare sfide significative nella scienza riproduttiva, segnando un importante progresso nella ricerca sulla fertilità. Lo rivela un nuovo studio condotto dai ricercatori della Shinshu University, riportato su Biology of Reproduction. Le cellule uovo mature, o ovociti, sono essenziali per la fecondazione nelle tecnologie di riproduzione assistita. Tuttavia, alcuni ovociti “denudati”, o quelli privi dello strato protettivo di cellule della granulosa, non riescono a maturare. La tecnologia di riproduzione assistita, ART, è un trattamento per la fertilità in cui gli ovuli vengono rimossi dalle ovaie, combinati con lo sperma all’esterno del corpo umano e gli embrioni risultanti vengono posizionati nell’utero. In genere, gli ovuli o gli ovociti crescono all’interno di sacche piene di liquido, chiamate follicoli nell’ovaio. Le cellule della granulosa, GC, circondano l’ovulo in via di sviluppo e forniscono nutrienti e ormoni essenziali. Tuttavia, i follicoli in fase iniziale hanno solo un sottile strato di GC e durante l’isolamento per i trattamenti per la fertilità, queste cellule possono staccarsi dall’ovulo, lasciando dietro di sé ovociti “denudati”, che non sono in grado di maturare e non possono essere utilizzati nell’ART. Ora, Kanako Morohaku e il suo gruppo di ricerca, presso la Shinshu University, hanno identificato un nuovo metodo per produrre ovuli vitali in grado di formare embrioni da ovociti denudati prelevati da follicoli “preantrali” nei topi. I follicoli preantrali rappresentano uno stadio di sviluppo precedente, a differenza dei follicoli antrali più maturi solitamente utilizzati nell’ART. Mentre la ricerca precedente si concentrava sui follicoli antrali, ci sono stati tentativi limitati di ottenere ovuli vitali dai follicoli preantrali. Per affrontare questo problema, i ricercatori hanno isolato ovociti denudati e GC dai topi, che sono stati poi coltivati insieme in una capsula di laboratorio a forma di ‘U’ per otto giorni. Ciò ha portato alla formazione di complessi di cellula della granulosa-oocita, o GOC, che hanno permesso agli ovociti di interagire di nuovo con le cellule di supporto. In uno studio precedente, la squadra di scienziati ha scoperto che la qualità degli ovociti era influenzata dalla concentrazione di ossigeno in cui venivano coltivati i GOC. Quindi, questi ovociti sono stati coltivati con GC in concentrazioni di ossigeno elevate, del 20%, e basse, del 5%, per osservare la differenza nella crescita degli ovociti. I ricercatori hanno osservato che bassi livelli di ossigeno miglioravano significativamente lo sviluppo dei GOC e stimolavano la formazione di proiezioni transzonali, sottili connessioni cellulari necessarie per la crescita degli ovociti. Dopo otto giorni, questi GOC riassemblati sono stati coltivati su una membrana rivestita di collagene per altri quattro giorni, portando alla maturazione degli ovociti in uova fecondabili. Per testarne la vitalità, i ricercatori hanno fecondato le uova e trasferito 126 embrioni in topi femmina, dopodiché hanno ottenuto sei cuccioli vivi. ” Per quanto ne sappiamo, il nostro nuovo protocollo di coltura è il primo a ottenere con successo prole da ovociti denudati derivati da follicoli preantrali coltivati ricostruendo i GOC in vitro “, ha detto Tomohiro Kohama, studente di dottorato e uno degli autori dello studio. Le implicazioni dello studio vanno oltre il trattamento della fertilità umana. I ricercatori suggeriscono che questo nuovo metodo potrebbe giovare anche ad animali di grandi dimensioni come bovini e maiali, dove le tipiche tecniche di maturazione degli ovuli spesso falliscono a causa della struttura unica delle loro ovaie. Inoltre, l’approccio potrebbe aiutare a conversare con le specie in via di estinzione supportando la produzione ex vivo, al di fuori del corpo di un organismo, offrendo un nuovo modo per preservare le risorse genetiche. I ricercatori sono fiduciosi che questi risultati si riveleranno inestimabili per il campo dell’ART. ” La produzione di uova ex vivo è necessaria per il bestiame e gli animali in via di estinzione per un uso efficiente delle risorse genetiche, l’allevamento, la creazione di modelli animali per comprendere come si sviluppano le cellule germinali e per gli esseri umani come trattamento per l’infertilità “, ha affermato Morohaku. “Questo nuovo metodo potrebbe rivelarsi prezioso per animali come bovini e suini, le cui strutture ovariche rendono i metodi di coltura tradizionali meno efficaci”, ha proseguito Morohaku. Il gruppo di ricerca è ottimista sul fatto che le loro scoperte faranno progredire la biologia riproduttiva e i trattamenti per la fertilità. Migliorando la vitalità degli ovociti denudati, questo approccio innovativo potrebbe offrire una nuova speranza per gli individui che affrontano l’infertilità e contribuire alla conservazione delle specie in via di estinzione, secondo i ricercatori. “L’obiettivo è avere un impatto significativo sia sulla salute riproduttiva umana sia sulla preservazione della diversità genetica nel regno animale”, ha concluso Morohaku. (30Science.com)
Lucrezia Parpaglioni
Prodotti ovuli vitali da ovociti non sviluppati con la tecnologia in vitro
(12 Novembre 2024)

Lucrezia Parpaglioni
Sono nata nel 1992. Sono laureata in Media Comunicazione digitale e Giornalismo presso l'Università Sapienza di Roma. Durante il mio percorso di studi ho svolto un'attività di tirocinio presso l'ufficio stampa del Consiglio Nazionale delle Ricerche (CNR). Qui ho potuto confrontarmi con il mondo della scienza fatto di prove, scoperte e ricercatori. E devo ammettere che la cosa mi è piaciuta. D'altronde era prevedibile che chi ha da sempre come idolo Margherita Hack e Sheldon Cooper come spirito guida si appassionasse a questa realtà. Da qui la mia voglia di scrivere di scienza, di fare divulgazione e perché no? Dimostrare che la scienza può essere anche divertente.