Roma – La conversione della CO 2 in combustibile e sostanze chimiche utilizzando l’elettricità, nota anche come conversione elettrochimica della CO 2 , è un modo promettente per ridurre le emissioni. Questo processo ci consente di utilizzare il carbonio catturato dalle industrie e dall’atmosfera e trasformarlo in risorse che solitamente otteniamo dai combustibili fossili.
Per portare avanti la ricerca in corso su una conversione elettrochimica efficiente, gli scienziati dell’Università di Doshisha hanno introdotto un metodo economicamente vantaggioso per produrre preziosi idrocarburi dalla CO 2 . Lo studio è stato reso disponibile online il 17 maggio 2024 e pubblicato formalmente sulla rivista Electrochimica Acta . Il gruppo di ricerca, guidato dal professor Takuya Goto e comprendente la signora Saya Nozaki della Graduate School of Science and Engineering e il dottor Yuta Suzuki dell’Harris Science Research Institute, ha prodotto etilene e propano su un elettrodo basico d’argento (Ag) utilizzando un liquido ionico contenente idrossidi metallici come elettrolita.
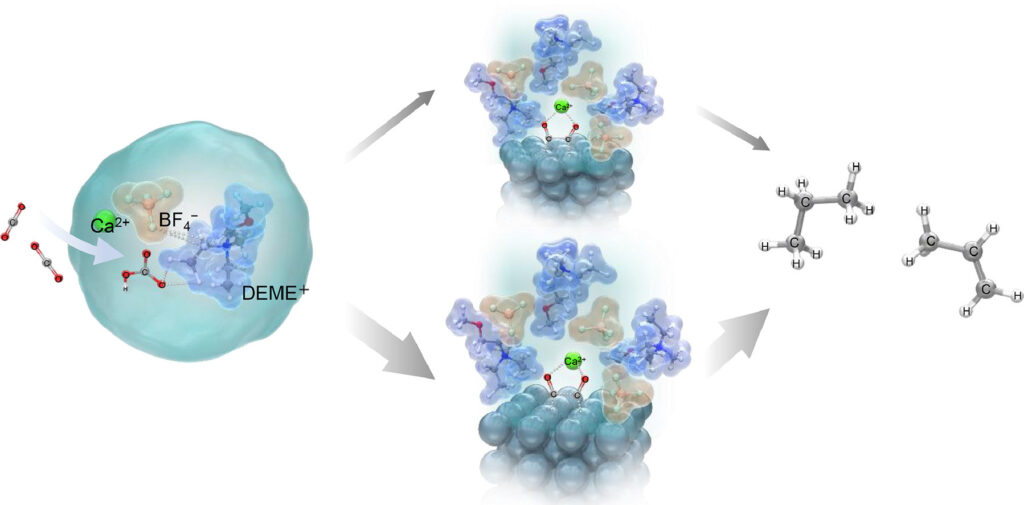
La produzione di idrocarburi avviene attraverso due intermedi formati sulla superficie dell’elettrodo d’argento per produrre idrocarburi utili come etilene, etano, propilene e propano.
CREDITO
Takuya Goto dell’Università Doshisha
“La maggior parte degli studi sull’elettrolisi della CO 2 con elettrolita liquido a temperatura ambiente si sono concentrati sulle proprietà catalitiche dell’elettrodo. In questo studio innovativo ci siamo concentrati sull’elettrolita e siamo riusciti a produrre prezioso gas idrocarburico anche da un semplice elettrodo metallico», afferma il prof. Goto.
I liquidi ionici offrono vantaggi unici per la riduzione elettrochimica della CO 2 . Funzionano su un’ampia gamma di tensioni senza decomporsi, non sono infiammabili e hanno punti di ebollizione elevati. Questa stabilità consente all’elettrolita di resistere alle alte temperature generate durante la riduzione esotermica della CO 2 .
Nel loro studio, i ricercatori hanno studiato la conversione elettrochimica della CO 2 e dell’acqua con N, N-dietil-N-metil-N-(2-metossietil) ammonio tetrafluoroborato (DEME-BF 4 ) come elettrolita. L’elettrolita DEME-BF 4 fornisce le condizioni ottimali per massimizzare la riduzione della CO 2 . Gli ioni DEME + aumentano la solubilità della CO 2 , consentendo a un maggior numero di molecole di CO 2 di partecipare alla reazione. Inoltre, data la sua natura idrofila, gli ioni idrogeno necessari per ridurre la CO 2 in idrocarburi possono essere facilmente forniti miscelando l’elettrolita con acqua.
I ricercatori hanno determinato che la conversione elettrochimica della CO 2 in idrocarburi potrebbe essere aumentata con l’aggiunta di soluzioni acquose contenenti idrossidi metallici come idrossido di calcio (Ca(OH) 2 ), idrossido di sodio (NaOH) e idrossido di cesio (CsOH) all’elettrolita . Gli idrossidi nel liquido ionico possono reagire con la CO 2 per formare bicarbonati (HCO 3 − ) e carbonati (CO 3 2− ), aumentando ulteriormente la disponibilità della CO 2 per partecipare alle reazioni elettrochimiche.
Sotto elettrolisi a temperatura ambiente (298 K o 25°C) in un’atmosfera di CO 2 , i ricercatori hanno ridotto con successo la CO 2 in etilene (C 2 H 4 ), etano (C 2 H 6 ), propilene (C 3 H 6 ) e propano (C 3 H 8 ). Hanno raggiunto le massime efficienze di corrente per ciascun prodotto utilizzando l’elettrolita DEME-BF 4 miscelato con acqua e contenente Ca(OH) 2 , con efficienze che raggiungono l’11,3% per il propano e il 6,49% per l’etilene. Questa efficienza ha superato di oltre 1000 volte quelle ottenute con altri idrossidi metallici.
Il motivo di questa elevata efficienza è stato spiegato utilizzando la spettroscopia Raman e i calcoli della teoria del funzionale della densità (DFT). Queste analisi hanno rivelato che gli ioni bicarbonato, formati quando la CO 2 interagisce con gli ioni OH – nell’elettrolita, interagiscono con gli ioni DEME + e BF 4 – dell’elettrolita per formare una struttura stabile [DEME + -BF 4 − -HCO 3 − -Ca 2+ ].
Le specie CO 2 e HCO 3 vengono quindi adsorbite sulla superficie dell’elettrodo formando specie adsorbite CO – annunci . Gli ioni CO – adsorbiti interagiscono quindi fortemente con gli ioni Ca 2+ presenti nell’elettrolita, formando due distinte strutture intermedie: Una struttura A, costituita da uno ione Ca 2+ coordinato con due ioni CO − adsorbiti su tre atomi di Ag, e l’altra struttura Struttura B, dove lo ione Ca 2+ è coordinato con due ioni CO − adsorbiti su due atomi di Ag. Questa interazione con gli ioni Ca 2+ è cruciale poiché aumenta la stabilità delle specie adsorbite, rendendo possibili le successive reazioni elettrochimiche.
Tra queste strutture, i ricercatori suggeriscono che la struttura B è più stabile ed è il percorso preferito per l’etilene, mentre la struttura A porta alla produzione di propano. “Abbiamo dimostrato che la personalizzazione dell’elettrolita può portare a cambiamenti a livello molecolare nella trasformazione di fase della CO2 in soluzione sfusa e nell’interfaccia elettrodo/elettrolita liquido ionico e abbiamo proposto un processo che consente la sintesi di idrocarburi unici come C3 ” , dice il prof. Goto.
Questi risultati fanno luce sui processi coinvolti nella conversione della CO 2 all’interfaccia tra elettroliti ionici a base liquida ed elettrodi metallici, come ad esempio il ruolo degli ioni calcio. Tali intuizioni possono aiutare nello sviluppo di elettroliti per la produzione efficiente di idrocarburi utili dalla CO 2 . “ La conoscenza fisico-chimica di questo nuovo percorso dalla decomposizione della CO2 alla sintesi di idrocarburi utili, come rivelato in questo studio, sarà determinante per far avanzare la tecnologia di utilizzo della CO2 e contribuire al progresso accademico nella scienza dei materiali ”. conclude il prof. Goto.(30Science.com)