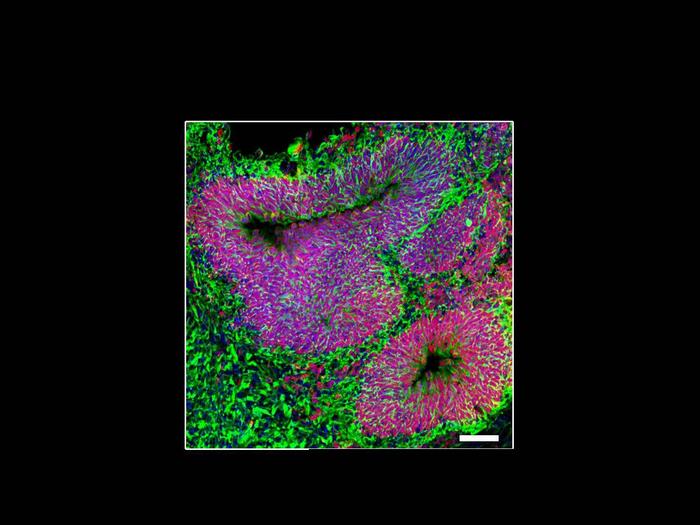
Roma – Sviluppati, da cellule staminali generate da pazienti con una forma rara e grave di disturbo dello spettro autistico e disabilità intellettiva, “mini-cervelli” personalizzati, o organoidi, in grado di fornire nuove conoscenze sul disturbo dello spettro autistico e suggerire potenziali nuovi trattamenti. A farlo gli scienziati di Scripps Research in uno studio pubblicato su Molecular Psychiatry. Gli organoidi sviluppati in laboratorio hanno permesso al gruppo di ricerca di acquisire una nuova comprensione di come una mutazione genetica porti al disturbo dello spettro autistico. Gli scienziati hanno anche dimostrato che un farmaco sperimentale, chiamato NitroSynapsin, ha invertito alcune delle disfunzioni cerebrali associate all’autismo in questi modelli. “Il nostro lavoro mostra come questa mutazione genetica che è stata associata all’autismo, interrompe il tipico equilibrio delle cellule cerebrali durante lo sviluppo”, ha detto Stuart A. Lipton, professore emerito della Step Family Foundation e co-direttore del Neurodegeneration New Medicines Center presso Scripps Research, neurologo clinico e autore senior della ricerca. ” Ma – ha continuato Lipton – abbiamo anche stabilito che potrebbero esserci modi per affrontare questo squilibrio più avanti nella vita”. Il disturbo dello spettro autistico, ASD, è una condizione neurologica e dello sviluppo che colpisce le interazioni sociali, gli interessi, i comportamenti ripetitivi e la comunicazione. Le cause dell’ASD sono solo parzialmente note; diverse varianti genetiche sono state associate al disturbo, ma ciascuna spiega solo una piccola percentuale di casi. Per molti anni, gli studi sull’ASD si sono concentrati sulla modellazione del disturbo nei topi o sullo studio di cellule cerebrali umane isolate. Nessuna delle due è una perfetta imitazione della complessità di un cervello umano interconnesso. Lipton e i suoi colleghi si sono concentrati sulla sindrome da aploinsufficienza MEF2C (MHS), una forma rara e grave di ASD e disabilità intellettiva causata da una variazione genetica nel gene MEF2C. I ricercatori hanno utilizzato cellule della pelle isolate da pazienti con MHS e hanno attinto a moderne tecniche di biologia delle cellule staminali per trasformare quelle cellule in staminali umane, per poi farle crescere in piccoli organoidi “mini-cervello”, di dimensioni millimetriche, in cui i ricercatori potevano studiare come i vari tipi di cellule cerebrali interagiscono tra loro. “Potevamo riprodurre aspetti essenziali del cervello dei pazienti per studiarne l’attività elettrica e altre proprietà”, ha affermato Lipton. “Abbiamo effettivamente portato i bambini in laboratorio per vedere i loro mini-cervelli ed è stato molto emozionante sia per i bambini che per le famiglie”, ha proseguito Lipton. Nei cervelli umani sani e negli organoidi cerebrali, le cellule staminali neurali si sviluppano in cellule nervose, o neuroni, che inviano e ricevono messaggi in tutto il cervello, nonché in vari tipi di cellule gliali, che sono cellule di supporto che hanno recentemente dimostrato di essere importanti nella segnalazione e nella funzione immunitaria. I cervelli sani contengono un equilibrio di neuroni eccitatori che promuovono la segnalazione elettrica e neuroni inibitori che bloccano questa segnalazione. L’autismo causa uno squilibrio eccitatorio/inibitorio, che spesso si traduce in troppa eccitazione. Negli organoidi sviluppati dalle cellule dei bambini con MHS, le cellule staminali neurali si sono sviluppate più spesso in cellule gliali, causando un numero sproporzionato di cellule gliali rispetto ai neuroni. In particolare, gli organoidi MHS avevano meno neuroni inibitori del solito, il che ha portato a un’eccessiva segnalazione elettrica nei mini-cervelli, proprio come molti veri cervelli umani con ASD. Quando il gruppo di Lipton ha indagato esattamente come le mutazioni MEF2C potessero portare a questo squilibrio tra i tipi di cellule, ha scoperto circa 200 geni che erano direttamente controllati dal gene MEF2C. Tre di questi geni si sono distinti: anziché codificare per il DNA che ha portato all’espressione di (m)RNA messaggero e quindi di proteine, hanno codificato geni per molecole di microRNA. I microRNA, o miRNA, sono piccole molecole di RNA che, anziché produrre proteine, si legano al DNA per controllare l’espressione genica. Questo mese, due scienziati hanno vinto il premio Nobel per la fisiologia o la medicina 2024 per il loro lavoro che descrive la scoperta delle molecole di miRNA e il modo in cui possono influenzare lo sviluppo e il comportamento delle cellule. “Nel nostro studio, alcuni miRNA specifici sembrano essere importanti nel dire alle cellule cerebrali in via di sviluppo se diventare cellule gliali, neuroni eccitatori o neuroni inibitori”, ha dichiarato Lipton. “Le mutazioni in MEFC2 alterano l’espressione di questi miRNA che, a loro volta, impediscono al cervello in via di sviluppo di creare cellule nervose e connessioni o sinapsi appropriate tra le cellule nervose”, ha proseguito Lipton. Il gruppo di Lipton ha scoperto che le cellule cerebrali in fase di sviluppo precoce dei pazienti con MHS presentano livelli inferiori di tre miRNA specifici. Quando i ricercatori hanno aggiunto copie extra di queste molecole di miRNA agli organoidi cerebrali derivati dai pazienti, i mini-cervelli si sono sviluppati più normalmente, con un equilibrio standard di neuroni e cellule gliali. Poiché l’ASD in genere non viene diagnosticato durante lo sviluppo cerebrale fetale, i trattamenti che mirano ad alterare lo sviluppo iniziale, come la correzione di un gene mutato o l’aggiunta di molecole di miRNA per fermare lo squilibrio dei tipi di cellule, non sono attualmente fattibili. Tuttavia, Lipton stava già sviluppando un altro farmaco che potrebbe aiutare a promuovere l’equilibrio tra neuroni eccitatori e inibitori, anche dopo lo sviluppo. Il gruppo di ricerca di Lipton ha recentemente testato un farmaco del genere, che lui e i suoi colleghi hanno inventato e brevettato con il nome di NitroSynapsin, noto anche come EM-036, per la sua capacità di ripristinare le connessioni cerebrali nei “mini-cervelli” ricavati da cellule colpite dalla malattia di Alzheimer. Nel nuovo articolo, hanno testato se il farmaco potesse anche aiutare a trattare la forma MHS di autismo. Utilizzando gli organoidi cerebrali derivati dai pazienti, Lipton e i suoi colleghi hanno dimostrato che negli organoidi cerebrali completamente sviluppati che presentavano uno squilibrio tra i tipi di cellule, NitroSynapsin poteva correggere parzialmente lo squilibrio, prevenendo l’ipereccitabilità dei neuroni e ripristinando l’equilibrio eccitatorio – inibitorio nel mini-cervello. Ciò ha anche protetto le connessioni delle cellule nervose o sinapsi. Sono necessari ulteriori studi per dimostrare se il farmaco migliora i sintomi dei pazienti con MHS o influenza altri tipi di disturbo dello spettro autistico che non sono causati da mutazioni nel gene MEF2C. “Stiamo continuando a testare questo farmaco su modelli animali con l’obiettivo di somministrarlo alle persone nel prossimo futuro”, ha annunciato Lipton. “Questo è un passo entusiasmante in quella direzione”, ha concluso Lipton. (30Science.com)
Lucrezia Parpaglioni
Mini-cervelli umani svelano la biologia dell’autismo e potenziali trattamenti
(28 Ottobre 2024)

Lucrezia Parpaglioni
Sono nata nel 1992. Sono laureata in Media Comunicazione digitale e Giornalismo presso l'Università Sapienza di Roma. Durante il mio percorso di studi ho svolto un'attività di tirocinio presso l'ufficio stampa del Consiglio Nazionale delle Ricerche (CNR). Qui ho potuto confrontarmi con il mondo della scienza fatto di prove, scoperte e ricercatori. E devo ammettere che la cosa mi è piaciuta. D'altronde era prevedibile che chi ha da sempre come idolo Margherita Hack e Sheldon Cooper come spirito guida si appassionasse a questa realtà. Da qui la mia voglia di scrivere di scienza, di fare divulgazione e perché no? Dimostrare che la scienza può essere anche divertente.