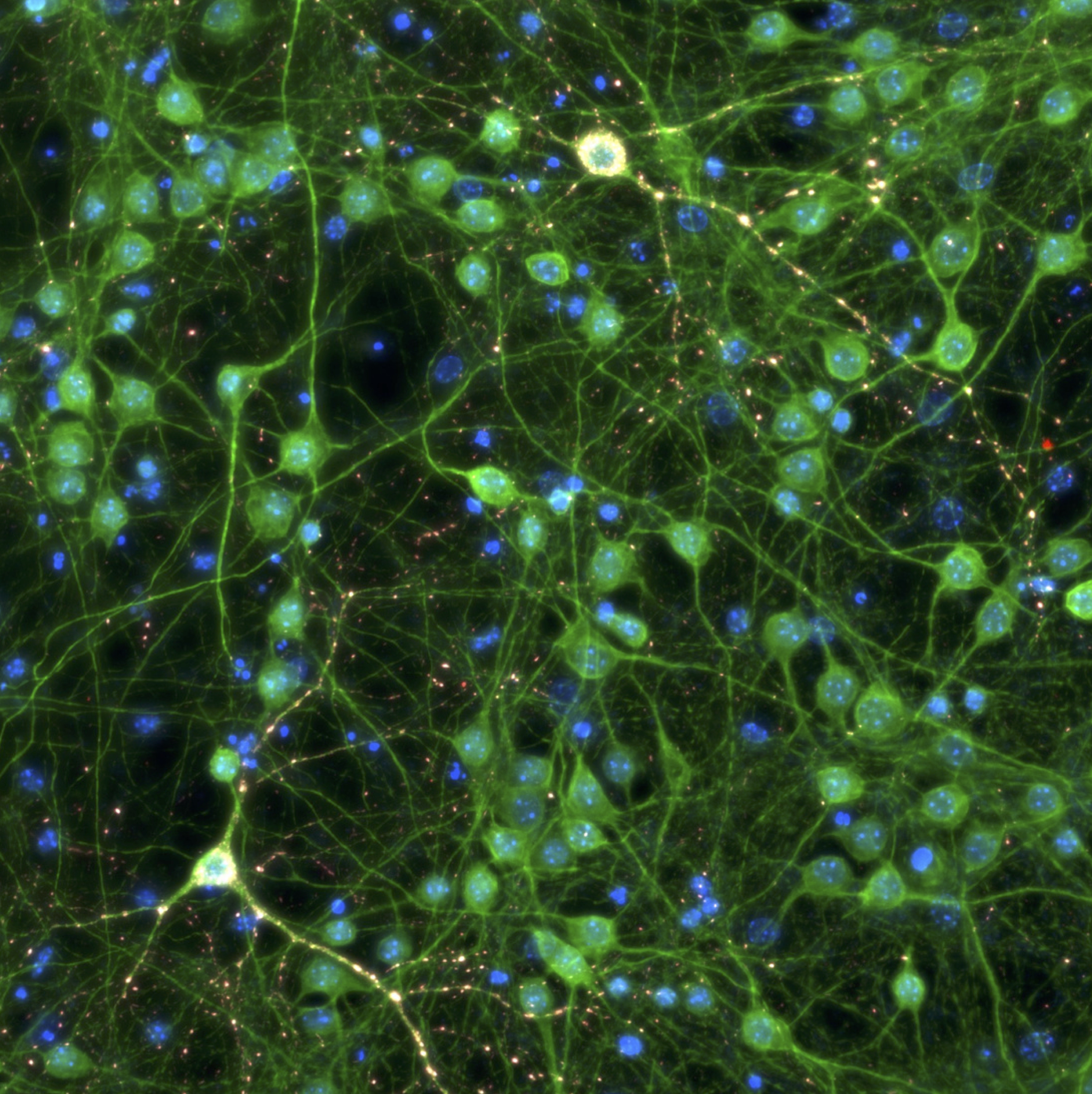
Roma – Una nuova terapia si è dimostrata efficace nel prendere di mira e distruggere gli aggregati delle proteine tau, segni tipici della malattia di Alzheimer, e nel migliorare i sintomi della neurodegenerazione nei topi. Lo rivela uno studio condotto da un gruppo di scienziati del Medical Research Council Laboratory of Molecular Biology, MRC LMB, di Cambridge, nel Regno Unito, e dell’UK Dementia Research Institute, UK DRI, dell’Università di Cambridge, descritto in due articoli, pubblicati su Cell e Science. Questo promettente approccio potrebbe essere applicato in futuro anche ad altri disturbi cerebrali causati dall’aggregazione di proteine all’interno delle cellule, come la malattia del motoneurone, la malattia di Huntington e il morbo di Parkinson. Gli scienziati hanno dimostrato come l’utilizzo delle capacità uniche di una proteina chiamata TRIM21 offra alle potenziali terapie due vantaggi chiave. In primo luogo, hanno distrutto solo gli aggregati di tau legati alla malattia, lasciando intatte le proteine tau sane. In secondo luogo, le terapie hanno rimosso gli aggregati di tau già presenti nei topi, non limitandosi a prevenire la formazione di nuovi aggregati. Sono due le principali proteine che si ripiegano male e si accumulano in aggregati nel cervello delle persone colpite dalla malattia di Alzheimer: la tau e l’amiloide. Gli aggregati di amiloide si formano negli spazi tra le cellule cerebrali, dove vengono presi di mira da nuove terapie a base di anticorpi, come il lecanemab. I “grovigli” di tau, invece, si formano in gran parte all’interno delle cellule nervose, anche se gli aggregati possono diffondersi da una cellula all’altra, il che è fortemente associato al declino cognitivo con il progredire della malattia. È difficile per le terapie anticorpali accedere alle tau all’interno delle cellule; queste non rimuovono gli aggregati di tau esistenti all’interno delle cellule, ma al massimo impediscono agli aggregati di diffondersi. Altre tecniche per colpire la tau all’interno delle cellule, come gli oligonucleotidi antisenso, ASO, hanno dimostrato di ridurre la tau in promettenti studi clinici in fase iniziale. Tuttavia, questi agiscono su tutte le tau presenti nel cervello e quindi rimuovono anche le tau“sane”, con effetti collaterali a lungo termine che non sono ancora noti. La proteina tau “sana” contribuisce normalmente a fornire un supporto strutturale alle cellule nervose del cervello, agendo come una sorta di impalcatura. Questa nuova tecnica per colpire i grovigli tau si avvale di una scoperta del 2010 del laboratorio di biologia molecolare MRC di Leo James sul ruolo di una proteina unica chiamata TRIM21, che è una parte fondamentale della risposta immunitaria ai virus. All’esterno della cellula, l’organismo produce anticorpi che si legano ai virus invasori. Quando il virus legato agli anticorpi entra in una cellula, TRIM21 lo rileva e lo etichetta come “spazzatura”, consegnandolo allo “scivolo dei rifiuti” della cellula, il proteasoma, per la distruzione. La stessa squadra di ricerca, che collabora con il DRI e l’MRC LMB del Regno Unito, ha dimostrato, nel 2023, che TRIM21 potrebbe essere riutilizzato per distruggere gli aggregati di proteina tau associati alla malattia di Alzheimer. Sostituendo gli anticorpi che legano i virus con anticorpi che si legano alla tau, TRIM21 è stato reindirizzato per inviare gli aggregati di tau alla distruzione da parte del proteasoma. TRIM21 è particolarmente adatta a questo scopo grazie a una caratteristica speciale: una parte della proteina, chiamata “RING”, che si attiva solo quando due o più proteine TRIM21 si raggruppano insieme. Ciò significa che si attiva e marca il suo bersaglio per la distruzione solo quando le proteine TRIM21 sono legate a proteine tau adiacenti e aggregate. Nei nuovi studi, gli scienziati hanno utilizzato TRIM21 per creare due nuove terapie per colpire gli aggregati di tau. La prima terapia, “RING-nanobody”, combina un nanobody che lega la tau, una versione in miniatura di un anticorpo, con il RING di TRIM21. La seconda terapia, “RING-Bait”, ha l’RING di TRIM21 unito a una copia della proteina tau stessa. La proteina tau legata all’RING funge da esca: gli aggregati la incorporano e anche l’RING di TRIM21 viene incorporato. Una volta che più RING-Bait vengono aggiunti all’aggregato, si attivano e causano la distruzione dell’intero aggregato. I ricercatori hanno somministrato il DNA che codifica le terapie TRIM21 in cellule contenenti tau aggregata e hanno scoperto che eliminava i grovigli di tau. Come si sperava, la tau “sana” è rimasta intatta. “Gli aggregati di tau sono nascosti all’interno delle cellule cerebrali e sono molto difficili da degradare”, ha sottolineato Will McEwan, co-leader degli studi, dell’UK Dementia Research Institute dell’Università di Cambridge. “È fondamentale che queste nuove terapie basate su TRIM21 possano essere somministrate direttamente all’interno delle cellule, dove risiede la maggior parte degli aggregati di tau” ha proseguito McEwan. “Abbiamo trovato un modo che non solo degrada gli aggregati di tau, ma lascia intatta la tau sana per svolgere il suo lavoro” ha affermato McEwan. “La nuova strategia va oltre i risultati che si possono ottenere con le attuali terapie ASO in fase di sperimentazione, in quanto potrebbe evitare i potenziali effetti collaterali a lungo termine dell’eliminazione della tau normale”, ha precisato McEwan. Poiché diverse malattie neurodegenerative possono avere diversi tipi di tau mal ripiegata, i ricercatori hanno testato le terapie su cellule contenenti proteine tau aggregate provenienti da tessuto cerebrale donato da persone affette da malattia di Alzheimer o paralisi sopranucleare progressiva, che presentano diverse strutture di tau mal ripiegata. La terapia RING-Bait è stata in grado di prevenire l’aggregazione della tau indotta da proteine provenienti da cervelli di pazienti affetti da Alzheimer e da paralisi sopranucleare progressiva. “Le malattie neurodegenerative possono avere proteine tau che si ripiegano in molti modi diversi, sollevando la possibilità di avere bisogno di un trattamento diverso per ogni malattia”, ha aggiunto Leo James, co-leader degli studi, del MRC Laboratory of Molecular Biology di Cambridge. “Un aspetto utile della RING-Bait è che, essendo attaccata a una proteina tau, è un cavallo di Troia universale che dovrebbe essere incorporato in diversi tipi di aggregati tau esattamente come la proteina tau mal ripiegata della cellula stessa”, ha dichiarato James. “Affinché il trattamento funzioni negli animali, è necessario che non solo entri nel cervello, ma anche all’interno delle cellule cerebrali”, ha sottolineato James. Per farlo, i ricercatori hanno utilizzato un virus innocuo che è stato precedentemente sviluppato per somministrare terapie di questo tipo, chiamato virus adeno-associato, AAV. Il virus fornisce le istruzioni del DNA per creare le proteine personalizzate all’interno delle cellule cerebrali. Ai topi anziani con aggregati di proteina tau è stata iniettata una singola dose del vettore di terapia genica contenente il trattamento o un placebo. Nel giro di poche settimane, si è registrata una riduzione significativa della quantità di tau aggregata nelle cellule cerebrali degli animali trattati. Inoltre, nei topi trattati con RING-Bait, la progressione dei sintomi della neurodegenerazione è rallentata e la loro funzione motoria è migliorata in modo significativo, come valutato da un programma di intelligenza artificiale che ha valutato la loro capacità di correre. “Non si sapeva se la rimozione specifica degli aggregati di tau all’interno della cellula fosse sufficiente a fermare la progressione della malattia”, ha notato Lauren Miller, autrice dello studio, che ha lavorato sia presso l’UK Dementia Research Institute che presso il MRC Laboratory of Molecular Biology. “È incoraggiante – ha continuato Miller – che l’approccio RING-Bait riduca la gravità della malattia nei nostri sistemi modello, poiché ciò suggerisce che la rimozione selettiva degli aggregati tau è un approccio terapeutico valido”. “Saranno necessari ulteriori lavori per dimostrare che questo effetto benefico si riscontra in più modelli di malattia umana”, ha aggiunto Miller. (30Science.com)
Lucrezia Parpaglioni
Nuova terapia distrugge i grovigli tau, implicazioni su cura Alzheimer
(13 Settembre 2024)

Lucrezia Parpaglioni
Sono nata nel 1992. Sono laureata in Media Comunicazione digitale e Giornalismo presso l'Università Sapienza di Roma. Durante il mio percorso di studi ho svolto un'attività di tirocinio presso l'ufficio stampa del Consiglio Nazionale delle Ricerche (CNR). Qui ho potuto confrontarmi con il mondo della scienza fatto di prove, scoperte e ricercatori. E devo ammettere che la cosa mi è piaciuta. D'altronde era prevedibile che chi ha da sempre come idolo Margherita Hack e Sheldon Cooper come spirito guida si appassionasse a questa realtà. Da qui la mia voglia di scrivere di scienza, di fare divulgazione e perché no? Dimostrare che la scienza può essere anche divertente.