Roma – Come agenti infiltrati, le cellule leucemiche sono in grado di allearsi con alcune cellule sane dal sangue che, come se fossero loro complici, le aiutano a proliferare e le difendono dalle terapie. In pratica le cellule malate possono contare su un microambiente tumorale che le protegge e fa loro da scudo. Per contrastare questo fenomeno, che si verifica in particolare nella leucemia mieloide acuta (LMA), i ricercatori della Fondazione Tettamanti hanno sviluppato in laboratorio una versione geneticamente modificata dei linfociti T, il tipo di globuli bianchi che ha specifiche funzioni difensive. Le cellule così modificate sono in grado di riconoscere e aggredire sia le cellule leucemiche, sia la particolare categoria di cellule sane che le protegge, ovvero le mesenchimali stromali (MSC).
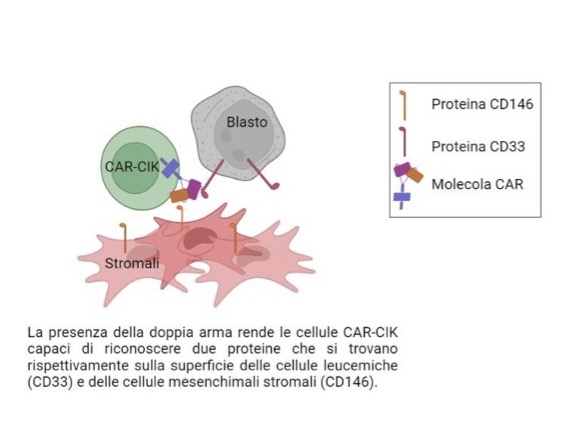
Per ottenere questi risultati i ricercatori hanno dotato i linfociti T di una doppia arma: due differenti proteine capaci di intercettare e interagire con altre due proteine che si trovano rispettivamente sulla superficie delle cellule leucemiche (il marcatore CD33) e sulle cellule mesenchimali stromali o MCS (il marcatore CD146). Le seconde offrono protezione alle prime.
I dati, pubblicati sulla rivista scientifica internazionale Frontiers in Immunology, derivano da esperimenti con cellule in coltura. Innanzitutto, hanno confermato che le MSC cercano di intralciare le terapie e per questo indicano la necessità di utilizzare strategie di attacco sinergico per contrastare più efficacemente la leucemia mieloide acuta.
I linfociti T utilizzati nello studio sono cellule CAR-CIK (Cytokine-Induced Killer) e rappresentano una ulteriore e necessaria evoluzione della terapia CAR-T (Chimeric Antigen Receptor T cell), finalizzata a contrastare patologie molto complesse e aggressive come la leucemia mieloide acuta. Se nella terapia CAR-T i linfociti T sono prelevati dai pazienti e modificati, con le CAR-CIK i linfociti T sono estratti dal sangue di un donatore attraverso un processo più semplice e meno costoso, che non richiede l’utilizzo di vettori virali (i virus inattivati, utilizzati nelle CAR-T per modificare il DNA dei linfociti e renderli cellule-farmaco contro il tumore).
Marta Serafini, capo Unità Cellule staminali e Immunoterapia della Fondazione Tettamanti – IRCCS San Gerardo dei Tintori di Monza, e Sarah Tettamanti, ricercatrice della Fondazione Tettamanti, commentano: “Per un trattamento efficace della leucemia mieloide acuta è necessario superare alcuni ostacoli, come il microambiente tumorale che circonda le cellule staminali leucemiche e le cellule leucemiche più mature (o blasti). Tale microambiente è creato e regolato dall’interazione bidirezionale continua tra le stesse cellule leucemiche e le cellule non ematopoietiche del midollo osseo. Queste ultime non portano alla formazione degli elementi del sangue (globuli rossi, globuli bianchi, mastociti, piastrine ecc.) ma contribuiscono in vario modo alla sopravvivenza e alla moltiplicazione delle cellule ematopoietiche, comprese quelle geneticamente alterate che portano allo sviluppo della leucemia. Per questo il microambiente tumorale sembra essere un bersaglio terapeutico promettente, verso cui indirizzare nuove strategie di trattamento per combattere la leucemia mieloide acuta, in aggiunta all’aggressione diretta delle cellule leucemiche”.
Andrea Biondi, direttore scientifico della Fondazione Tettamanti e dell’IRCSS San Gerardo dei Tintori di Monza, osserva: “Tra i diversi tipi di cellule non ematopoietiche di supporto presenti nella nicchia del microambiente tumorale, le cellule mesenchimali stromali (MSC) sembrano avere un ruolo chiave nel proteggere le cellule leucemiche e nel promuoverne la proliferazione. Ciò avviene tramite innumerevoli meccanismi che chiamano in causa il rilascio di sostanze, aumentando la sopravvivenza delle cellule tumorali. Per disinnescare questo meccanismo, lo studio è stato concepito in due fasi: nella prima, sono state create le cellule CAR-CIK ‘bispecifiche’ con i due recettori CD33/CD146; nella seconda, è stata valutata la capacità antileucemica di queste cellule CAR-CIK in esperimenti con cellule in coltura. I risultati confermano che nonostante le CAR-CIK riescano a colpire le cellule malate, il loro microambiente influisce sulla loro funzionalità. L’azione delle cellule CAR-CIK dovrà essere quindi verificata in esperimenti con animali di laboratorio. Tali studi aiuteranno anche a comprendere meglio i meccanismi che creano e mantengono la nicchia del microambiente tumorale nel midollo osseo dei pazienti con leucemia e, su queste basi, a perfezionare l’approccio terapeutico per ottimizzarne l’efficacia”.
Lo studio è stato realizzato in collaborazione tra i ricercatori della Fondazione Tettamanti e i colleghi del Centro di BioNanoMedicina (NANOMIB) e del Dipartimento di Medicina e Chirurgia dell’Università Milano-Bicocca (Monza) e del King’s College London (Londra, Regno Unito).(30Science.com)

