(30Science.com) – Roma, 25 giu. – L’Agenzia Europea dei Farmaci (EMA) ha raccomandato il rilascio di un’autorizzazione all’immissione in commercio condizionata nell’Unione Europea (UE) per Abecma (idecabtagene vicleucel), una terapia genica per il trattamento di pazienti adulti con mieloma multiplo recidivante e refrattario che hanno ricevuto almeno tre precedenti terapie, tra cui un agente immunomodulatore, un inibitore del proteasoma e un anticorpo anti-CD38 e il cui cancro è peggiorato dall’ultimo trattamento.
Il mieloma multiplo è un raro tumore di un tipo di globuli bianchi chiamati plasmacellule. Le plasmacellule normali si trovano nel midollo osseo e sono una parte importante del sistema immunitario. Le plasmacellule producono gli anticorpi che consentono al corpo di riconoscere e attaccare germi come virus o batteri. Nel mieloma multiplo, la proliferazione delle plasmacellule è fuori controllo, con conseguente moltiplicazione di plasmacellule anormali e immature e riempimento del midollo osseo. Quando le plasmacellule diventano cancerose, non proteggono più il corpo dalle infezioni e producono proteine anomale che possono causare problemi ai reni, alle ossa o al sangue.
Nonostante lo sviluppo e l’approvazione di una serie di nuovi farmaci per il trattamento del mieloma multiplo negli ultimi anni, esistono limitate opzioni terapeutiche per i pazienti che hanno già ricevuto tre principali classi di farmaci (agenti immunomodulatori, inibitori del proteasoma e anticorpi monoclonali) e non rispondono più a questi medicinali. Pertanto, sono necessari nuovi farmaci per i pazienti la cui malattia si ripresenta dopo il trattamento.
Abecma è una terapia con cellule T del recettore dell’antigene chimerico autologo geneticamente modificato ( CAR) e la prima terapia genica basata su cellule per il trattamento di pazienti adulti con mieloma multiplo. Ogni dose di Abecma viene creata raccogliendo le cellule T del paziente (cioè globuli bianchi che aiutano il corpo a combattere le infezioni) e modificandole geneticamente in modo che includano un nuovo gene che aiuta il corpo a colpire e uccidere le cellule del mieloma. Queste cellule immunitarie modificate vengono quindi reinfuse nel sangue del paziente.
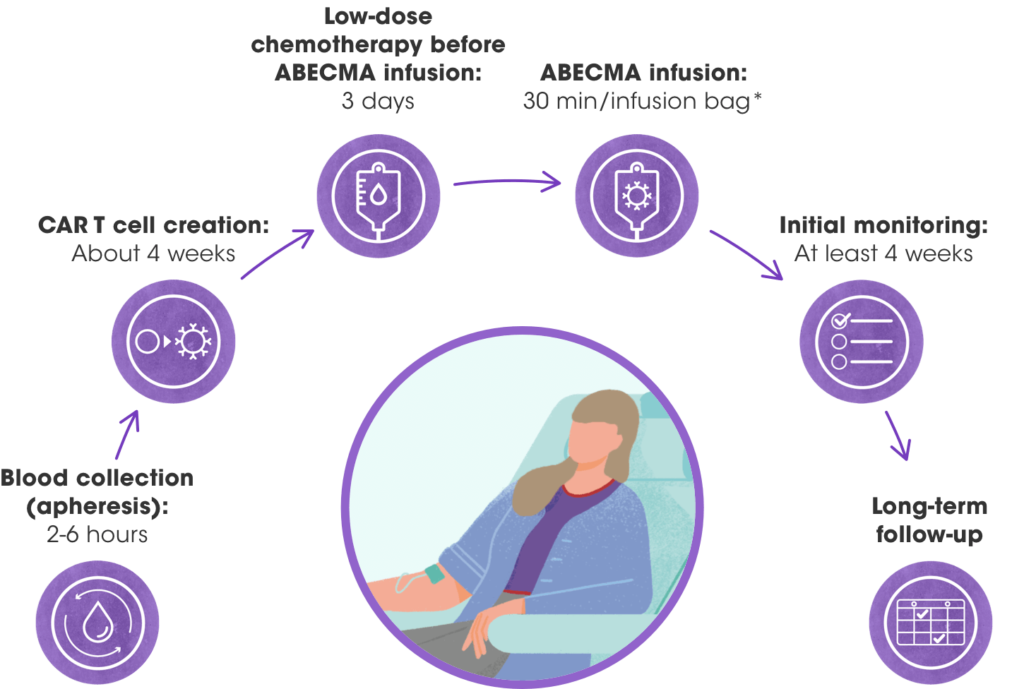
There are 6 steps to treatment with ABECMA Dal sito https://www.abecma.com/receiving-abecma
Abecma è stato sostenuto attraverso il programma PRIority MEdicines (PRIME) dell’EMA, che fornisce un supporto scientifico e normativo tempestivo e potenziato ai medicinali che hanno un potenziale particolare per soddisfare le esigenze mediche non soddisfatte dei pazienti.
Lo studio principale su cui si basa la raccomandazione per un’autorizzazione all’immissione in commercio condizionata è stato uno studio clinico di fase 2, multicentrico, in aperto, a braccio singolo. Lo studio ha valutato l’efficacia e la sicurezza di Abecma in 140 pazienti adulti con mieloma multiplo recidivante o refrattario che avevano ricevuto almeno tre precedenti terapie, tra cui un agente immunomodulatore, un inibitore del proteasoma e un anticorpo anti-CD38, e che non hanno risposto a l’ultimo regime di trattamento.
Circa il 67% dei pazienti arruolati nello studio ha risposto al trattamento e ha mantenuto la remissione (un periodo senza segni o sintomi di malattia dopo il trattamento) per circa 11 mesi in media. Di quelli studiati, il 30% ha mostrato una risposta completa (cioè scomparsa dei segni di cancro).
I principali problemi di sicurezza legati alla somministrazione di Abecma sono la sindrome da rilascio di citochine (CRS) (cioè una condizione che causa febbre, vomito, mancanza di respiro, mal di testa e bassa pressione sanguigna) , tossicità neurologica, citopenia (cioè basso numero di cellule nel sangue ) e infezioni, che possono essere pericolose per la vita. Le strategie di monitoraggio e mitigazione di questi effetti collaterali sono descritte nelle informazioni sul prodotto e nel piano di gestione dei rischi che è parte integrante dell’autorizzazione.
Ulteriori dati sull’efficacia e sulla sicurezza vengono raccolti attraverso la presentazione di dati di follow-up dallo studio clinico principale e attraverso uno studio in corso che confronterà l’ efficacia e la sicurezza del medicinale con i regimi tripli standard in pazienti con mieloma multiplo recidivante e refrattario.
Poiché Abecma è un medicinale per terapie avanzate (ATMP), è stato valutato dal Committee for Advanced Therapies (CAT), dal comitato di esperti dell’EMA per i medicinali a base di cellule e geni e dal comitato per i medicinali umani (CHMP) dell’EMA, che ha raccomandato l’approvazione.(30science.com)